Содержание
- Эпидемиология
-
Профилактика рака желудка
- Первичная профилактика
- Вторичная профилактика (скрининг рака желудка)
-
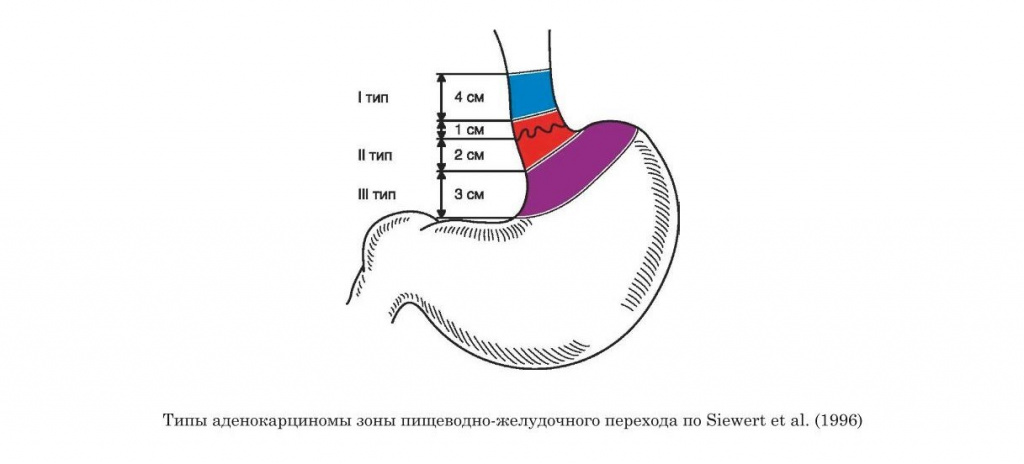
Правила стадирования рака желудка
- Основные изменения 7-й редакции классификации TNM
- Изменения японских классификаций JGCA (13-е и 14-е издания)
- Понятие раннего и местно-распространенного рака желудка
-
Правила описания первичной опухоли
- Макроскопический тип опухоли
-
Правила описания регионального метастазирования
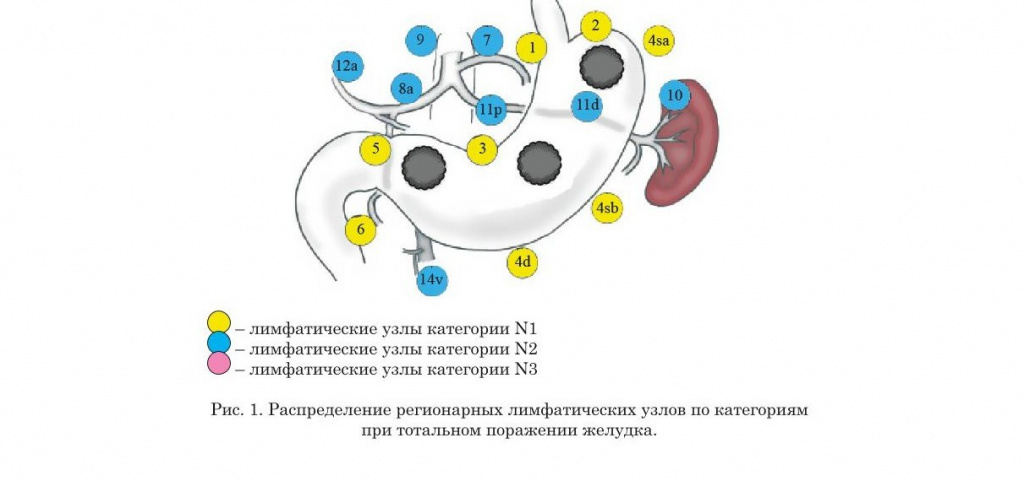
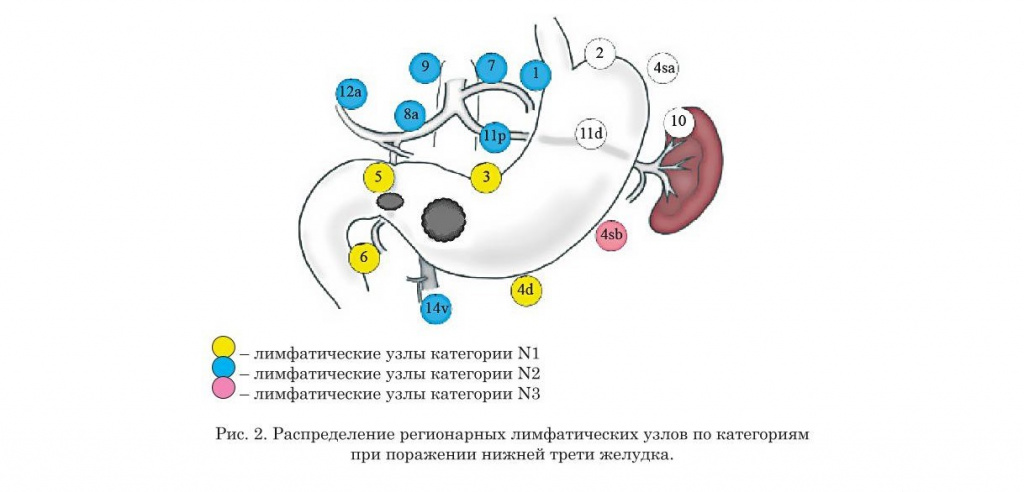
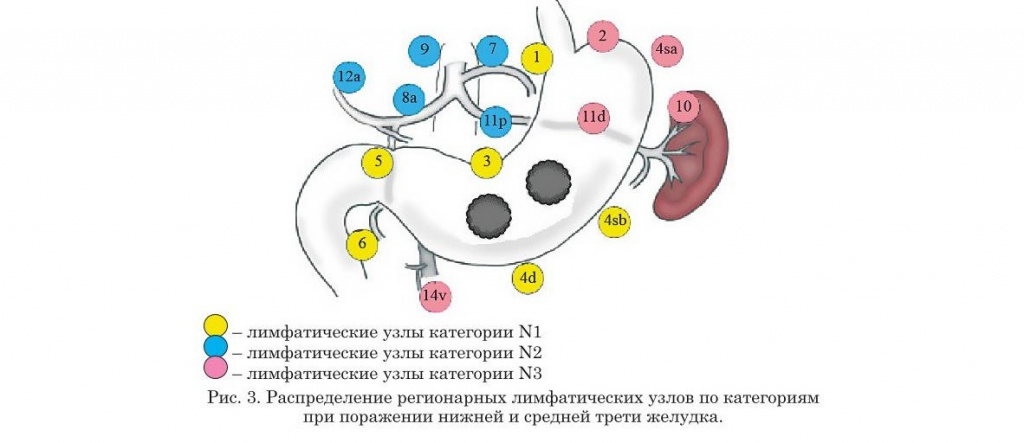
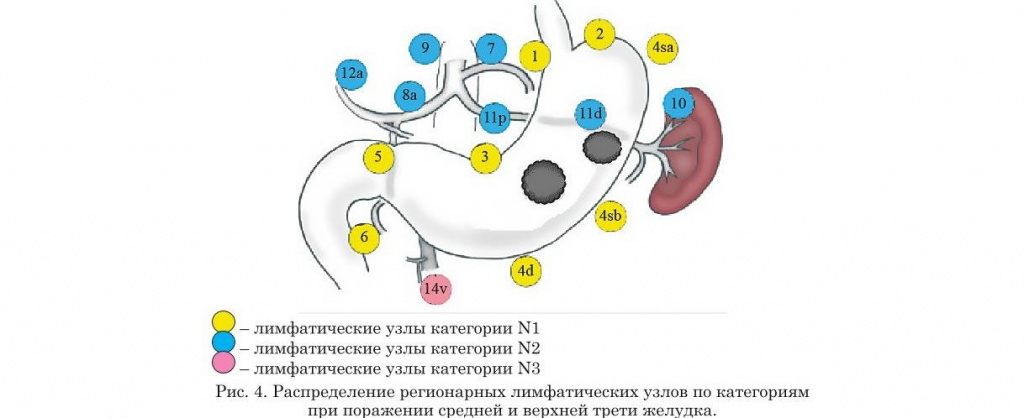
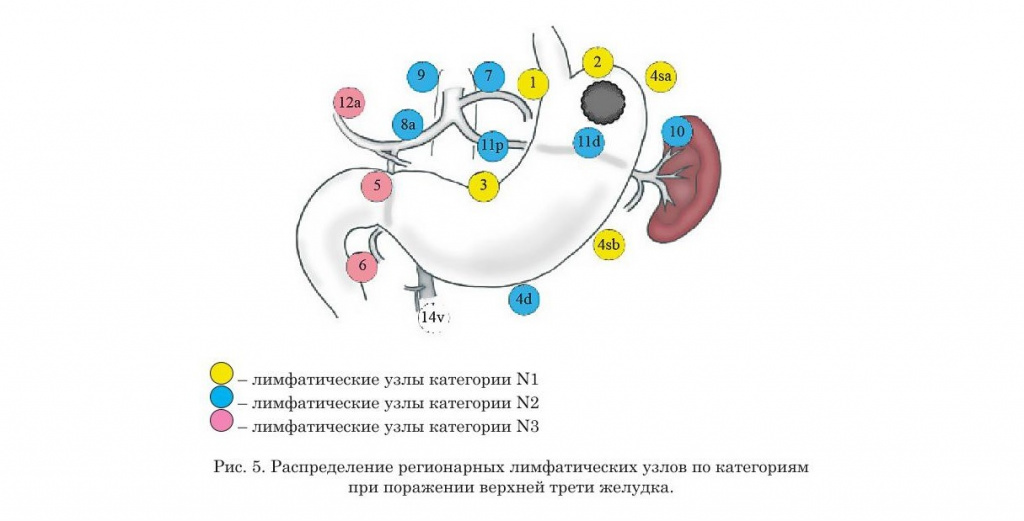
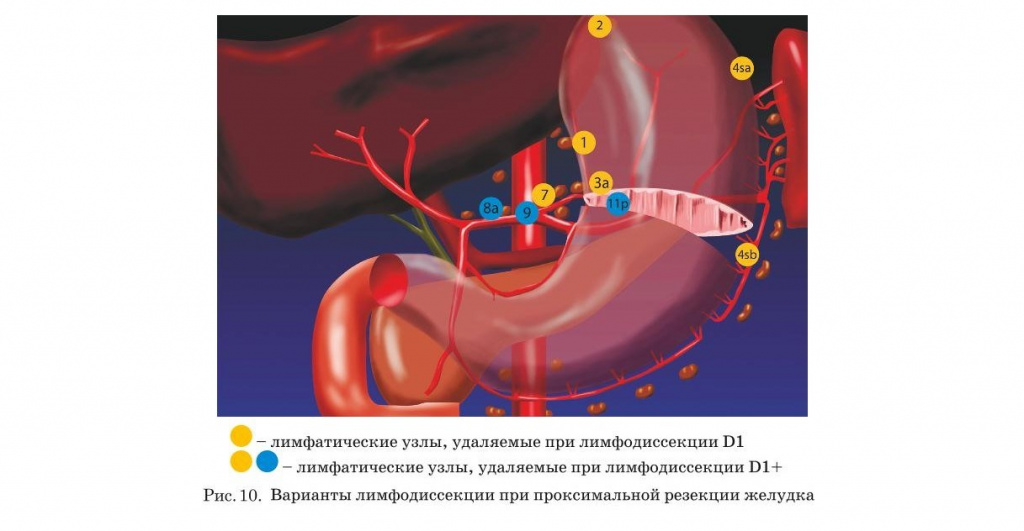
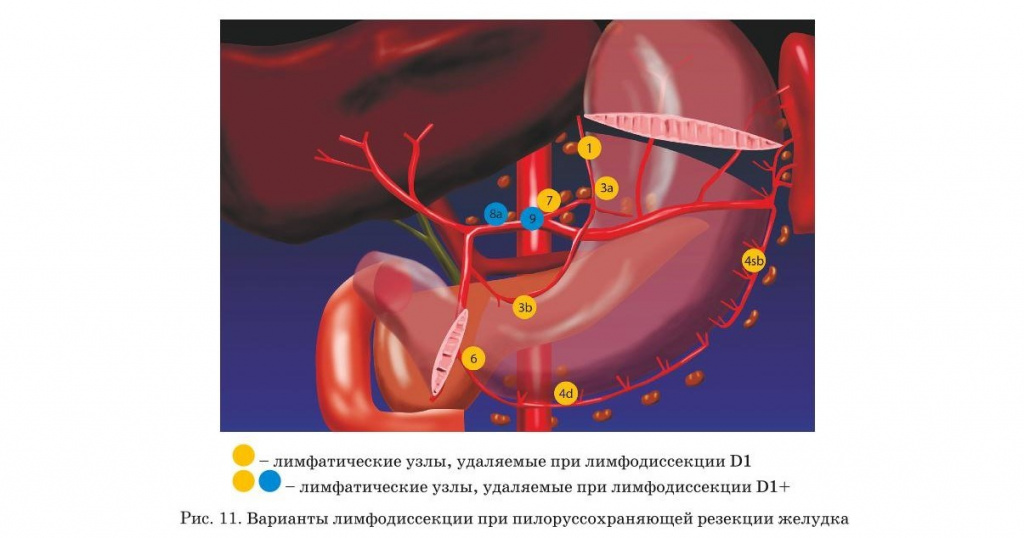
- Нумерация регионарных лимфатических узлов желудка
- Распределение регионарных лимфатических узлов желудка по категориям в зависимости от локализации опухоли (предыдущая классификация)
-
Обследование пациента с опухолью желудка
- Общие принципы стадирования
- Эндоскопическая диагностика
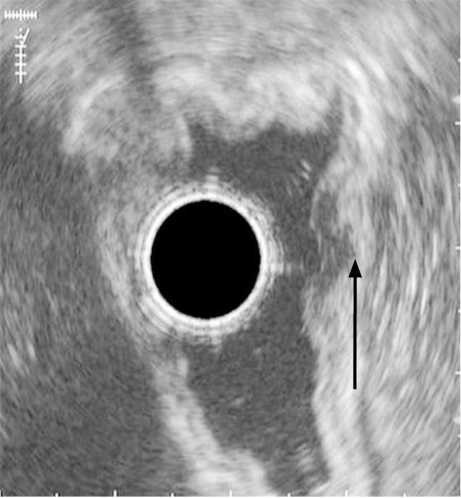
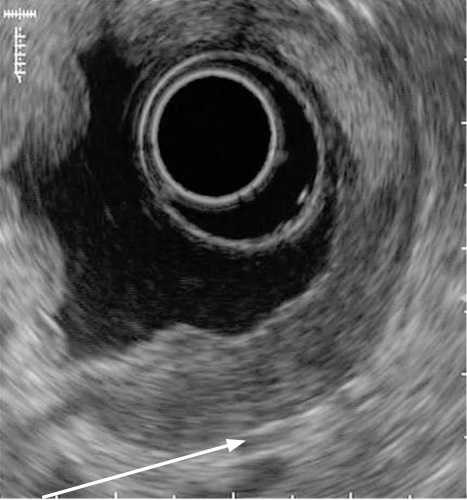
- Эндосонографическая диагностика
- Применение лучевых методов диагностики при стадировании рака желудка
-
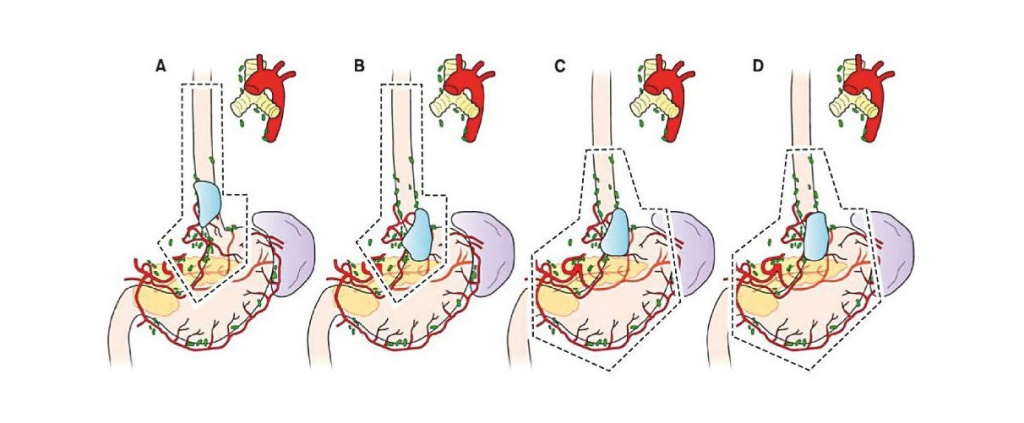
Хирургическое лечение. Типы операций
- Край резекции
- Рекомендации по выбору объема удаляемого органа
- Упрощенное правило для местно-распространенных форм рака
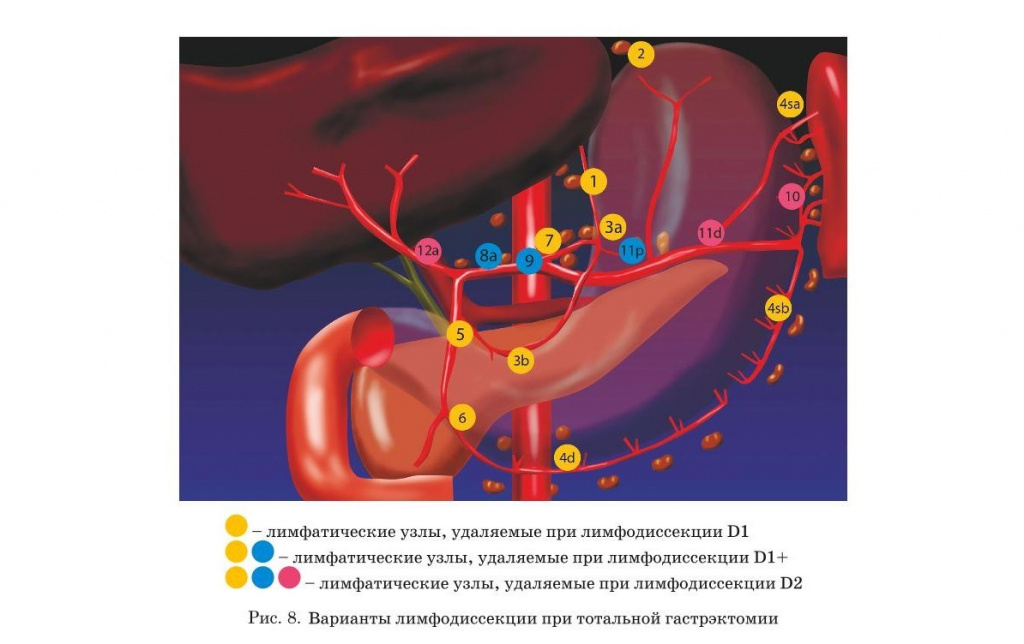
- Определение объема лимфодиссекции в зависимости от TNM-стадии
- Спленэктомия
- Лапароскопическая хирург
-
Варианты реконструкции после резекции желудка, гастректомии
- Реконструкция после пилоруссохраняющей резекции
- Варианты техники анастомозирования
- Вариант последовательности этапов выполнения дистальной резекции желудка с лимфодиссекцией D2
- Эндоскопические резекции
-
Принципы ведения пациентов после хирургического лечения
- Принципы хирургии быстрого восстановления (Fast Track Surgery)
- Принципы антибиотикопрофилактики
- Антикоагулянтная терапия
-
Системная противоопухолевая терапия
- Линии химиотерапии при раке желудка
- Интерпретация удаленного препарата
-
Междисциплинарное планирование лечебной программы при раке желудка в зависимости от стадии заболевания
- Общие принципы
-
Приложение
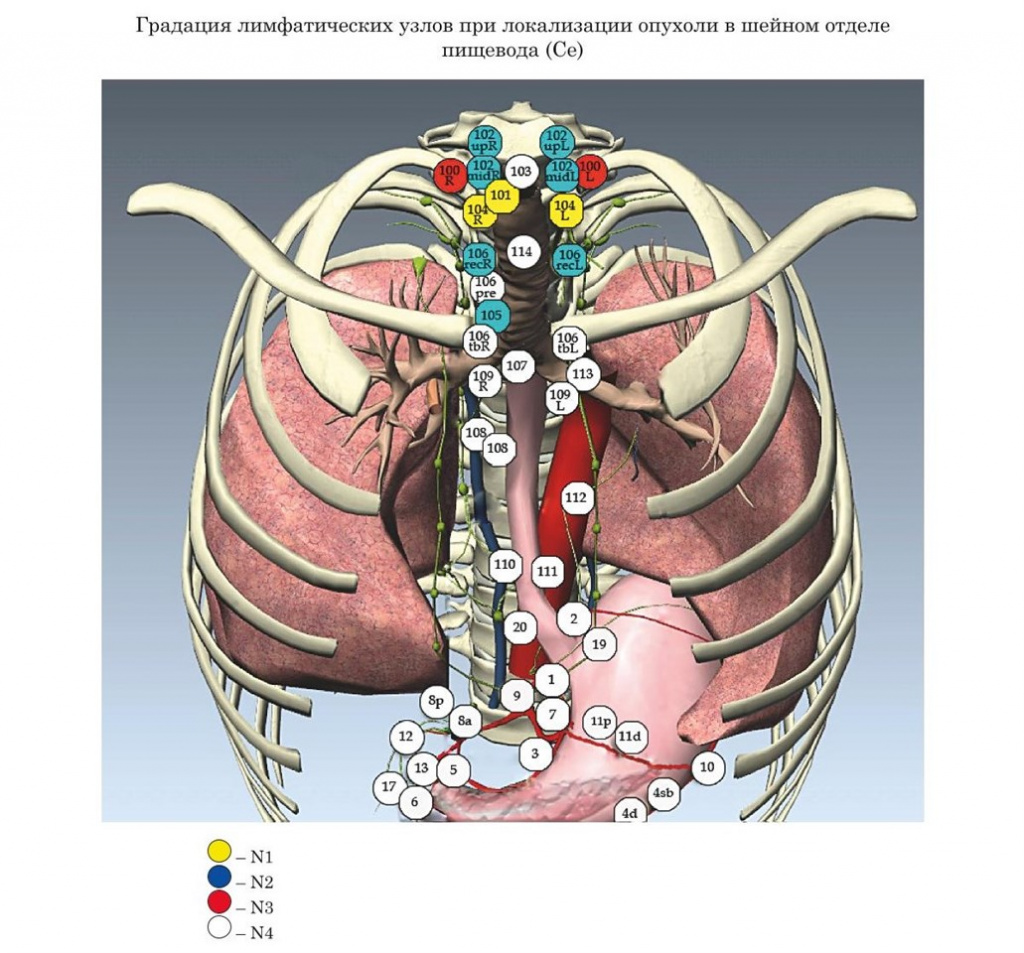
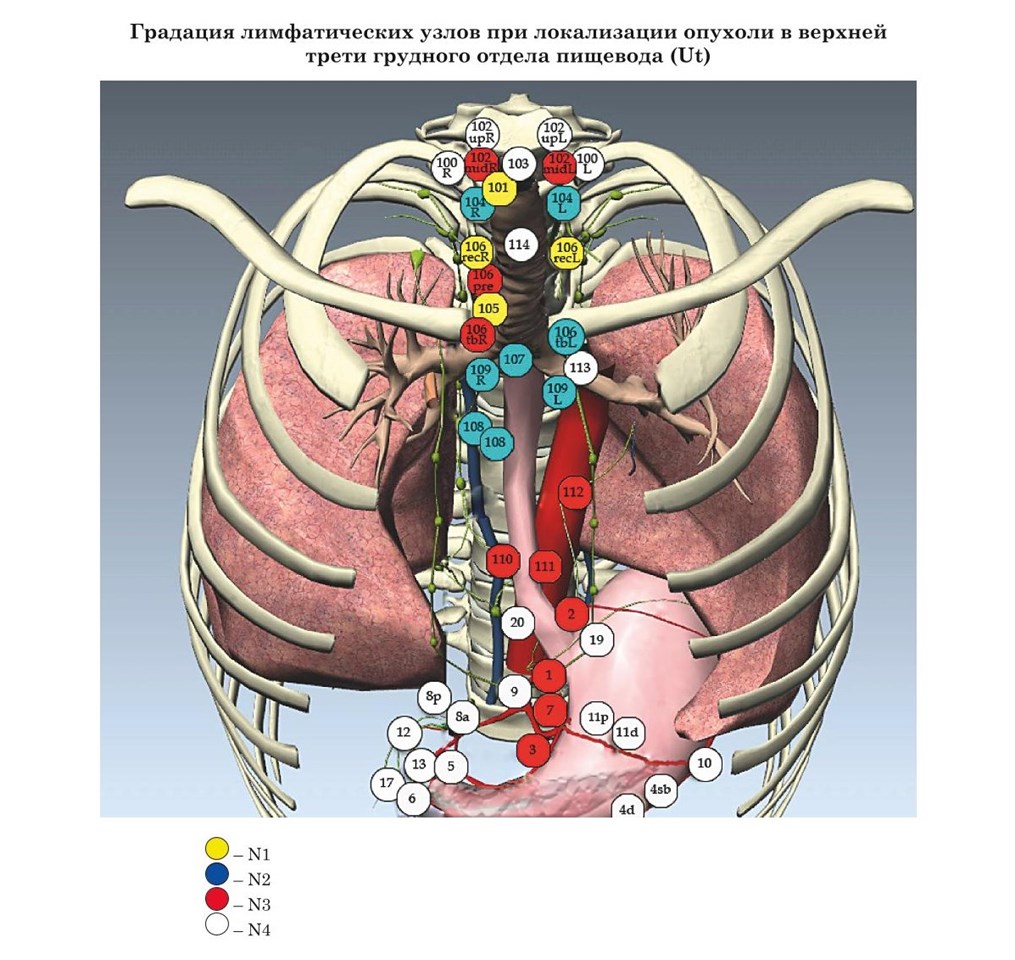
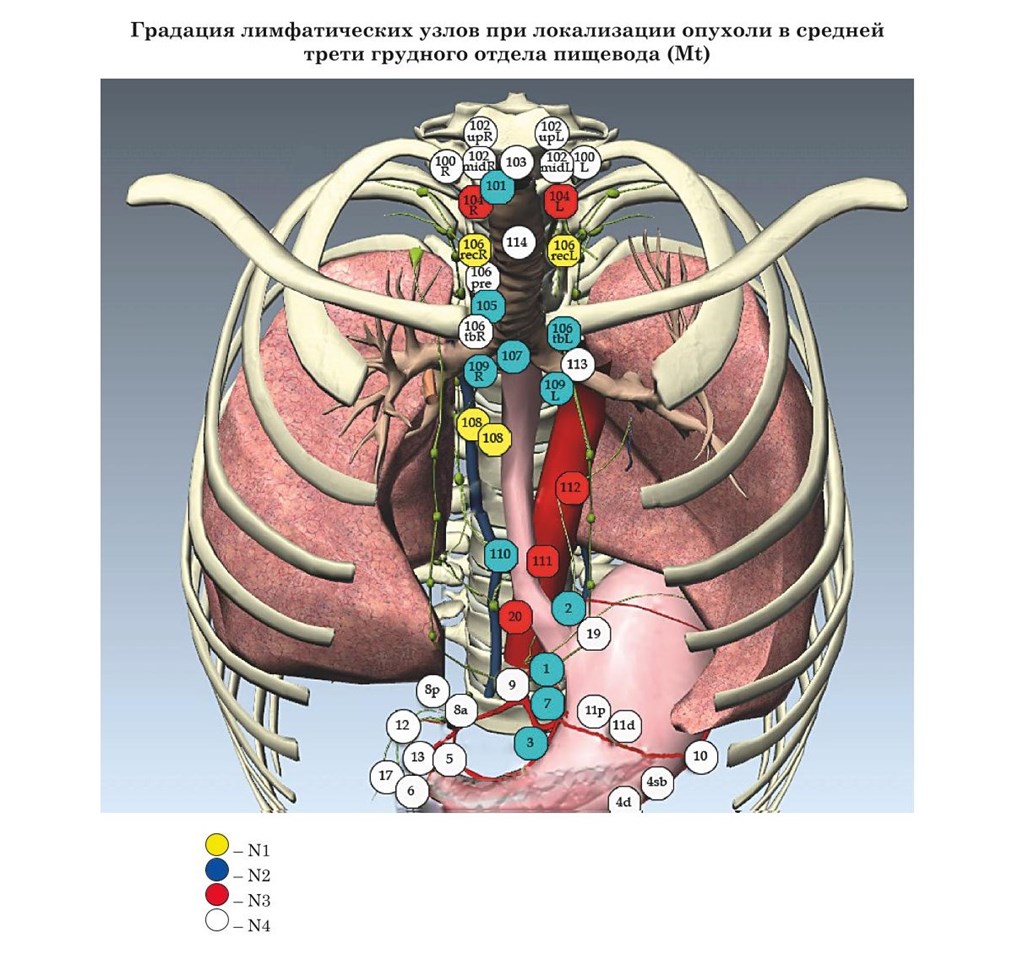
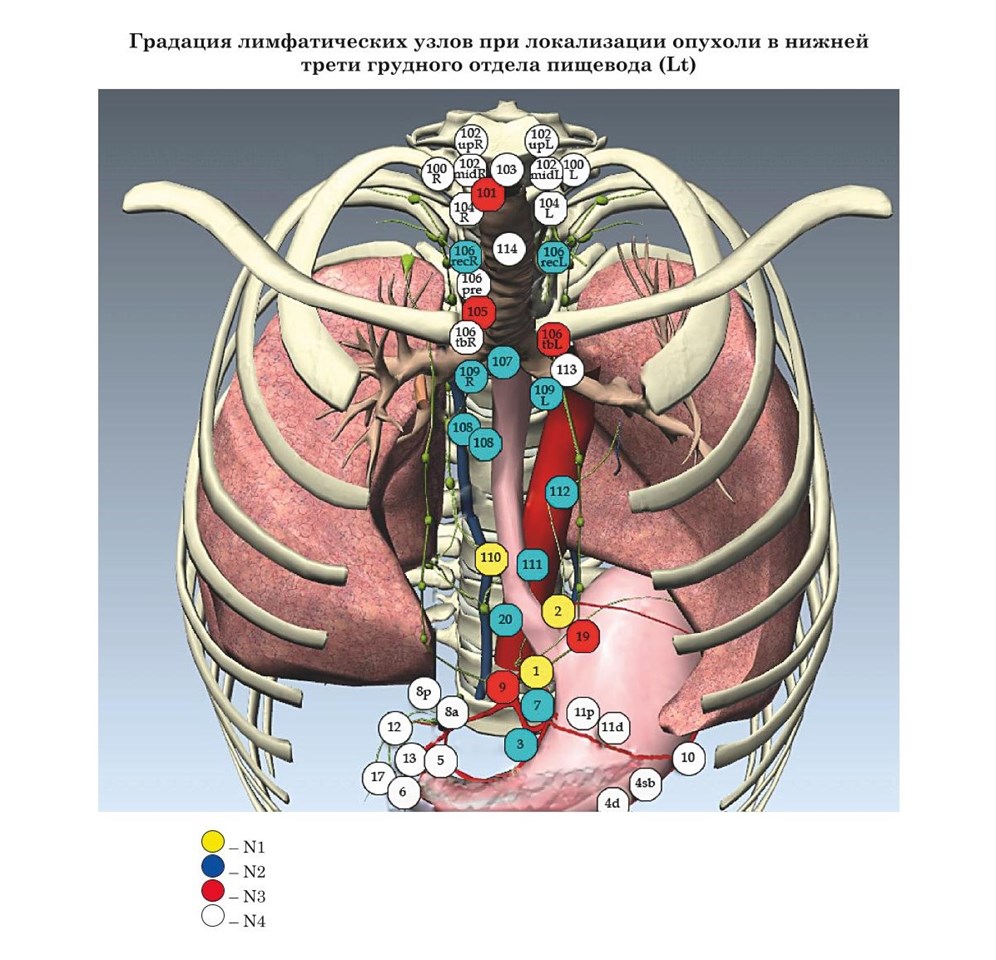
- Японские рекомендации градации лимфатических узлов при раке пищевода в зависимости от локализации опухоли (JSED)
- Уровни радикальной лимфодиссекции при раке пищевода (конференция ISDE Мюнхен, 1994 г.)
- Уровни радикальной лимфодиссекции при раке пищевода (JSED, 1999 г.)
- Международные рекомендации лимфодиссекции при раке пищевода (конференция ISDE Мюнхен, 1994 г.)
- Список литературы










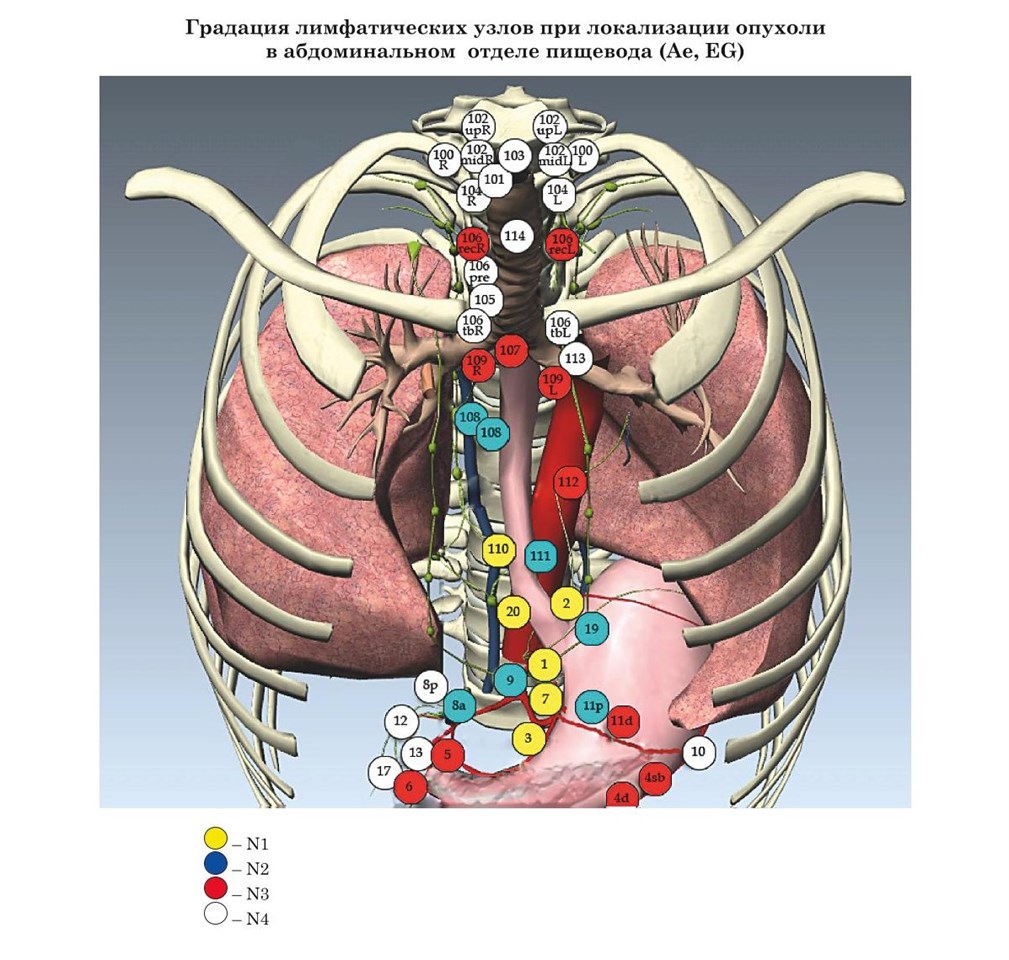
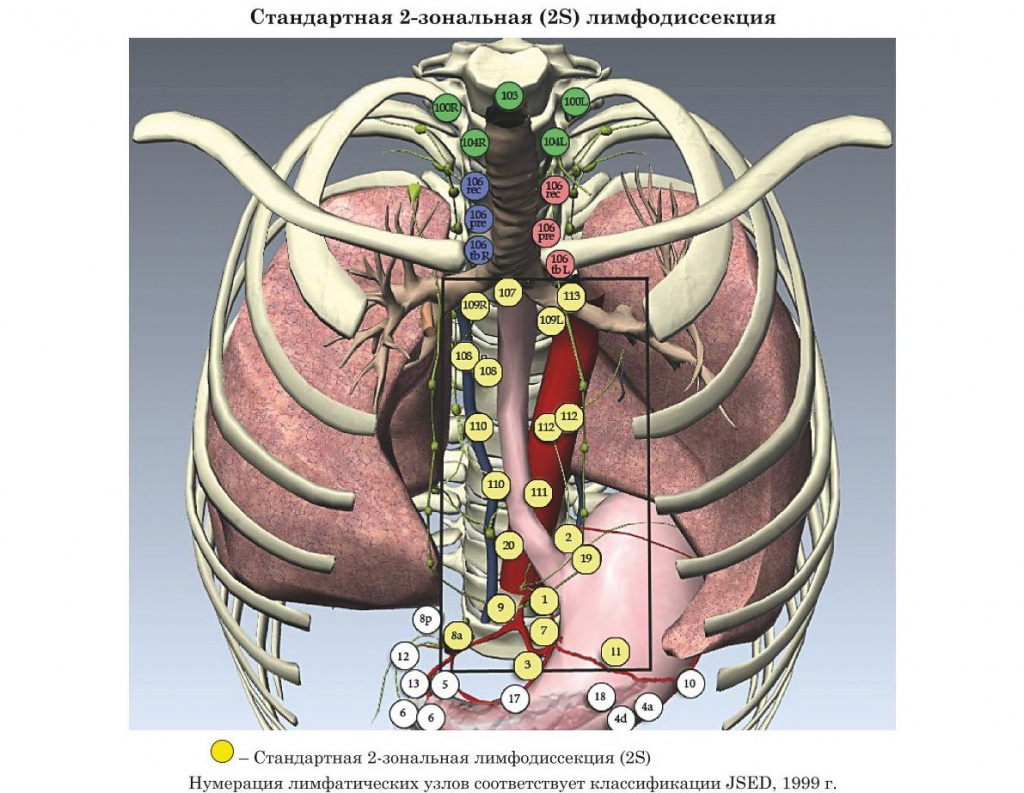
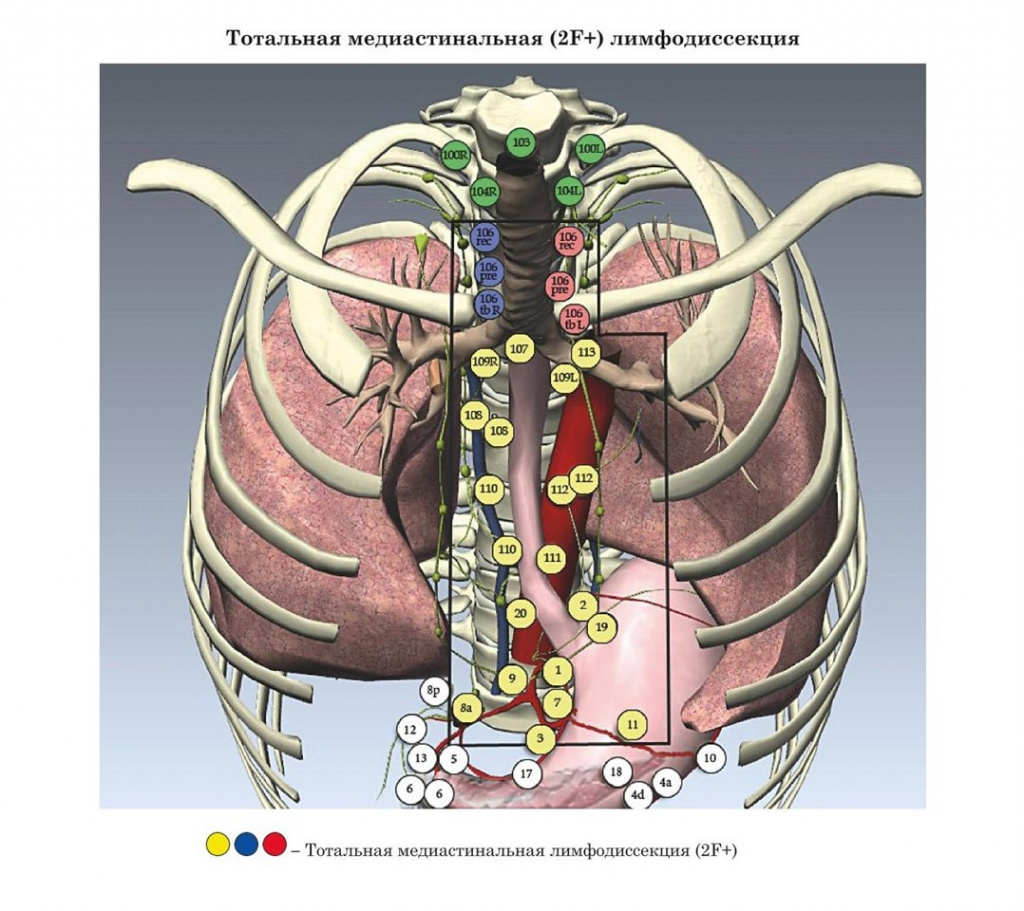
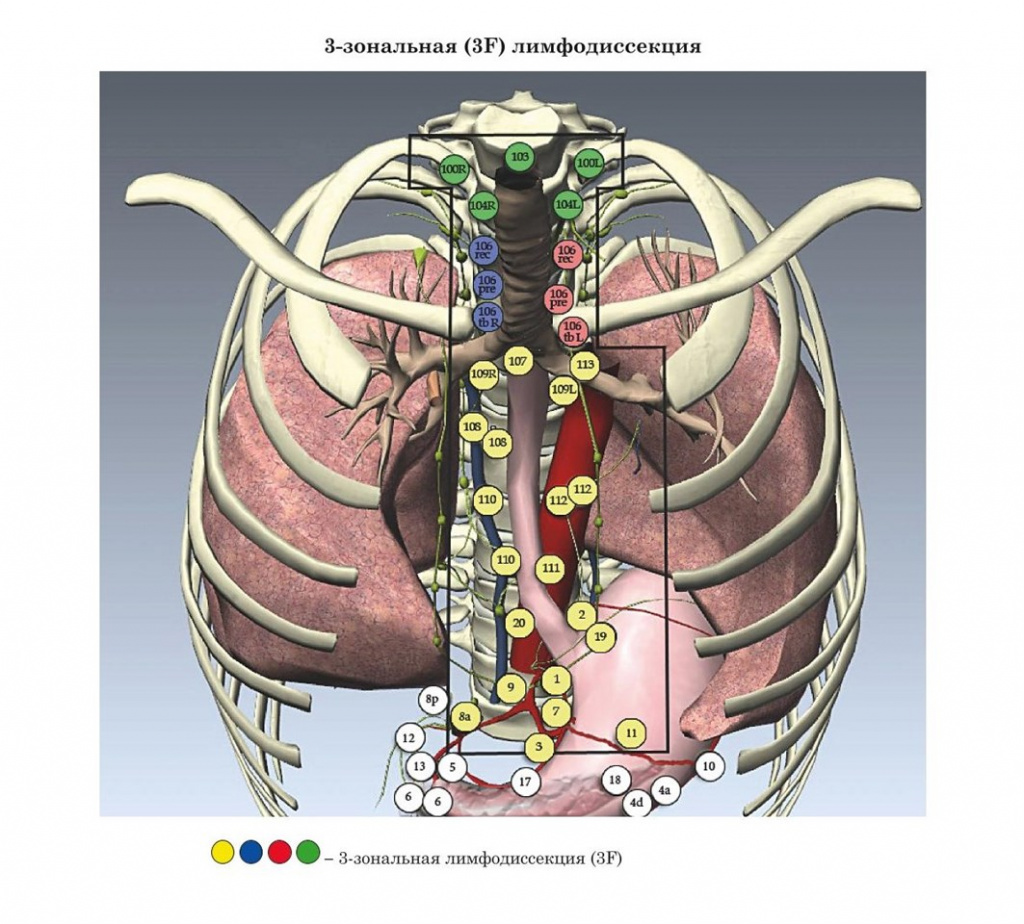
В основу настоящего издания легли материалы современных практических рекомендаций: Японии, Европы и США.